FDA Quality Metrics電子データ報告手順発表
FDAが Quality Metrics の電子データでの報告の手順を発表しました。
QUALITY METRICS TECHNICAL CONFORMANCE GUIDE
Draft Guidance for Industry Request for Quality Metrics, published July 28, 2015
Revision History June 2016 1.0 Initial version
<原文はこちら>
これから、アメリカになどに輸出している製薬会社の皆様は本格的にFDAに対して、Quality Metricsのデータを収集・報告を検討することになります。
もうご準備は整っていますでしょうか。
■Quality Metricsとは
FDAはUS国内で販売している医薬品およびそのAPIの製造会社に、Quality Metricsの情報提出を義務付ける。
(2016年よりData収集、2017年より報告開始を予定)
製品毎、ラインごとにMetrics提出を希望
次の2点の的として強調しています。
1.FDAの査察計画を立案時に、査察対象の優先度・査察間隔・頻度を決定する為の基礎資料
2.医薬品の欠品の予測の資料
報告しなければいけない項目は、以下を含む最低10項目。
1.生産計画されたロット数
2.製造中・製造後(品質検査)に規格不適合になったロット数
3.生産計画中、30日以上出荷判定が保留のロット数
4.保存安定性試験を含めて、規格外(OOS)
5.....
少し驚いたのは、この報告を電子的に実施可能なんですが、その報告形式がXMLでと言うもの。
ほー。。。。なかなか進んでるなと思います。CSVなどであれば、すでの超一般的ですが、システムの世界以外でXMLにはあまりお目にかからないんではないかなと思います。
そこで弊社では、簡単にFDA報告用XMLファイルを作成するEXCELを作成いたしました。
その「簡単FDA報告用XMLファイル出力EXCEL」 を無償でご提供します。
(トレンドマイクロのウイルスバスター、EXCELマクロチェック済、パターンファイル:12.635.00)
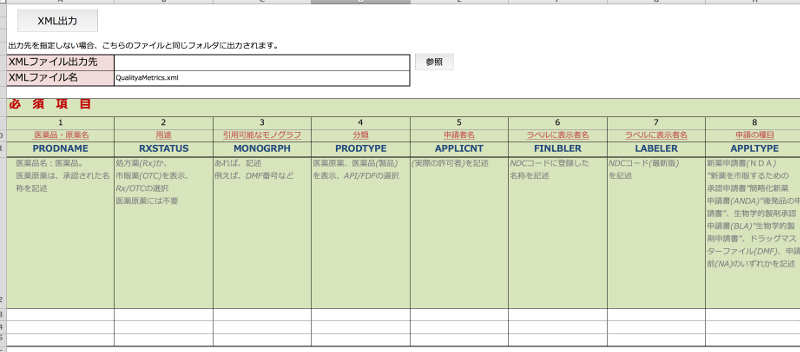
■XMLとは
Extensible Markup Language(エクステンシブル マークアップ ランゲージ)
詳細はウィキペディアで。

