データインテグリティ Data Integrity クラウドシステム導入チェックポイント
はじめに
フィラーシステムズ GxPシステムサービスチーム
医薬、製薬、医療機器業界におけるGMP、GQP、GDP、GCP、GLP、GPSP、GVPなどなどGxP関連業務、データインティグリティ(Data Integrity)のクラウドシステム導入のためのチェックポイントを列挙しております。きれいに整理はできておりませんが、御参考になれば幸いです。
弊社では、GMP対応システム開発、RFP・URS作成、導入コンサルティングなどお引き受けしていますので、お気軽にご相談ください。
- データインティグリティ(Data Integrity)観点といえば、ALCOAが原点。
ヨーロッパから始まったデータインテグリティへの関心の高まりは、製薬業界におけるグローバルでの課題となってきています。2018年に実施される日本の改正GMP省令でも、データインテグリティは改正の大きな柱の一つになっています。この規制要件の基本的な考え方は、ALCOA|ALCOA-CCEAの原則を考えることだと思います。下記はALCOA-CCEA|アルコア-プラス
| Attributable 帰属性 | 帰属/責任の所在が明確である。 データの記録者が明確である。 データを観測、記録、訂正した個人を特定し、?ることができる。 |
| Legible 判読性 | 判読/理解できる。誰もが間違いなく簡単に読み取ることができる。 |
| Contemporaneous 同時性 | 同時である。データが発生してからできるだけ速やかに記録する。日付を?って記録してはならない。 |
| Original 原本性 | すべての原本も保存する。最初に記録したもの。複製物や転記したものではない。 |
| Accurate 正確性 | 正確である。誤りがなく、完全である。 |
| Complete 完全性 | 完結している。 |
| Consistent 一貫性 | 矛盾がない。 原資料内の記録に矛盾がない。他の原資料との矛盾がない。 |
| Enduring 耐久性、普遍性 | 永続的である。 消去できない筆記具で記録する。 紛失を避け、損傷や劣化が最小限である適切な環境で、定 められた期間、保存する。 |
| Available when needed 要時利用可能 | 必要時に取り出せる。 保存期間中を通して、必要なときに速やかに取り出せる。 |
- Attributable 帰属性|帰属/責任の所在が明確である。
データの記録者が明確である。データを観測、記録、訂正した個人を特定することができる。
監査証跡データにおいてもそのデータの帰属性を保証すること - Legible 判読性 判読/理解できる。
誰もが間違いなく簡単に読み取ることができる。メタデータ(ラベル)とともにデータの保存が必要。また、テキスト以外の方法で保存されている情報やハードディスクが暗号化されているときは注意
印刷ができるようにしておくのも一手。ただし、その印刷物は参照用という取り扱い。 - Contemporaneous 同時性 同時である。
データが発生してからできるだけ速やかに記録する。日付を遡って記録してはならない。
システム時刻には注意。日常点検で自社標準時とのチェックを。(手記録用の時計などとの同期も) - Original 原本性 すべての原本も保存する。最初に記録したもの。複製物や転記したものではない。
俗に言う「生データ」。機器間、システム間でデータ連携する場合はどれが原本と規定するか。CSVがなされた機器、システム間において、人間が関与せずに自動的に連携されるデータであれば、どれも生データと規定できる。。。かな? - Accurate 正確性 正確である。誤りがなく、完全である。
システムが正しく動いていれば間違いないように思うが、小数点桁やアナログデータをどの精度でデジタル化するかという仕様を検討する際には、かなりの考慮が必要だと考えられる。 - Complete 完全性 完結している。
- Consistent 一貫性 矛盾がない。原資料内の記録に矛盾がない。他の原資料との矛盾がない。
関連あるデータを一覧できる、その関連性も示してくれる様に工夫しておくべきです。品質試験毎に必要な試験データは揃っているのか?記載内容に漏れはないのか?その判定の基準となったものは揃っているか?実施、記錄時刻の整合性は取れているか?組織と承認者、実施者の関係性に整合性はあるか? - Enduring 耐久性、普遍性 永続的である。
消去できない筆記具で記録する。紛失を避け、損傷や劣化が最小限である適切な環境で定められた期間、保存する。
磁気や光メディアであっても品質劣化する可能性が高いので十分に注意が必要です。ただし、バックアップのバックアップなどとしていくと原本製の担保や、ほんとにリストアできるのかのテストなどかなりの手間がかかることが難しいところです。 - Available when needed 要時利用可能 必要時に取り出せる。
保存期間中を通して、必要なときに速やかに取り出せる。
査察では30分以内に提出しないとワーニングレターが出る!などと噂を聞いたことがありますが、そこはデジタル化することでかなり利便性が上がることは間違いありません。ただし、その検索性には考慮が必要になると思います。会社の規模の拡大によって工場や組織が増えたり、変更されたりしますので、将来の展望も含めた検索条件を設定しましょう。また、全文検索が非常に役にたちます。しかも文書の中も合わせて検索してくれるツールがあれば最強です。
- 基本的な考え方
GCP(臨床試験)、GDP(流通)、GLP(非臨床試験)、GMP(製造・品質管理)、GQP(品質保証)、GVP(市販後安全管理)、GPSP(市販後調査) 業務に関わるシステムの導入について、リスクマネジメントを用いて検討する。上記対応要件に対しての対応可能、一部対応可能、対応不可等それぞれでリスクを洗い出し、対応できないリスクを許容できるのかを自社で検討する。
- 対応要件
・薬機法(医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律)
・CSV(Computerized System Validation)コンピュータ化システムバリデーション PDF版はこちら
・GAMP5
・ER/ES指針 ポイントは3つ(真正性、見読性、保存性) ※下記「ER/ES指針がこの話の元祖ですね」参照
・FDA Part11
・データインテグリティ(Data Integrity)
・GMP- manufacturing – 医薬品、医薬部外品の製造管理・品質管理の基準 厚労省サイト
・GDP – Distribution – 医薬品の適正流通基準 厚労省サイト
・GQP – quality – 医薬品、医薬部外品、化粧品及び医療機器の品質管理の基準 厚労省サイト
・GCP – clinical – 医薬品・医療機器の臨床試験の実施基準
・GLP – laboratory – 医薬品・医療機器の非臨床試験の実施基準
・GVP – vigilance – 医薬品、医薬部外品、化粧品及び医療機器の製造販売後安全管理の基準 厚労省サイト
・GPSP – Post-marketing Study – 製造販売後の調査・試験の実施基準
・QMS省令 – 医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令 厚労省サイト
・ISO27001
・ISO27017
・ISO13485
- システムの利用用途は?
| システム種別 | 製品例 |
|---|---|
| 生産管理システム | SAP、MCFrame、ASTROM、SMRi、JIPROS、tsPharma、CIMVisionPMS(MCFrame)、FutureStage、 |
| MES|製造管理システム | HITPHAMS、CIMVisionPharms、Pharmanage、PAS-X、Pharma Suite、EasyT@ct、ASTROM-MES、FactoryTalk、 |
| 在庫管理(製品、原材料)システム | |
| 購買管理システム | |
| 品質管理システム/LIMS | CIMVisionLIMS、Thermo Scientific SampleManager LIMS、tsPharma qcLIMS、ADME LIMS Debra、Discoverant、 |
| 製品情報管理システム/PLM | Windchill、BIOVIA Discoverant、Aras Innovator、Knowledge Explorer、MCFrame PLM |
| 品質保証ワークフロー | Trackwise、MasterControl、Agatha、業務デザイナー ※QA部門におけるイベント管理自動化の必要性 |
| 文書管理システム | Perma Document、Documentum、HITQUAA、Agatha |
| 臨床試験・治験管理システム | DDworks |
| サプライヤ管理システム | |
| 品質情報、逸脱、CAPA管理システム | |
| 販売管理システム | |
| MR支援システム | JUST.SFA、Veeva、Saleforce |
| 物流管理システム | |
| 倉庫管理システム/WMS | PARCKs -WMS、 |
| 配送管理システム |
- 導入システムが確かなものだという資料は揃っているか?
サプライヤから資料を提出、収集して検討する
例)利用規約、SLA
品質管理基準、開発管理基準、運用管理基準
文書管理規定、記録
運用会社が取得している第3者認証
要員管理、教育計画、記録など
変更管理(バージョンアップ)の開示(運用・開発環境)
運用体制(ハード、ソフトウェア)→データ変更・削除のリスクなど
サプライヤからの委託先、その管理
- サプライヤアセスメントは実施したか?
以下のサプライヤーに対して、システム選定時点で実施する。
例)
・パッケージ開発・販売会社 (SAP)
・パッケージ導入企業 (日立製作所)
・ITインフラ提供企業 (AWS)
実地、文書についてはどちらでも良い
参考資料
- システムのバージョンアップは自社でコントロールできるか?
ポイント
クラウドの場合、自社専用領域(サーバ、インスタンス)などを設置してい場合には、サービス全体でバージョンアップされてしまう場合がある。事前に連絡があるとはいえ、システム変更管理の観点から言うと、自社の意図しないシステム変更は割けたいところである。提供会社の信頼度など十分な検討が必要である。
- システム利用規約を確認したか?
認証の有無
提供資料の充実
業界(規制)への理解度
入力データの隔離性
入力データの取扱い・・運用会社がデータに触れる場合の確認
サービスの停止・・・・サービスが停止される可能性の確認
サービスの廃止・・・・サービス廃止される可能性の確認
保証範囲・・・・・・・最終的なデータ保全は基本的に保証されない
委託・・・・・・・・・第3者に開発、運用などを委託する可能性
- システムのSLA(Service Level Agreement)サービス品質保証を確認したか?
SaaS向けSLAガイドライン|経産省
例)
・可用性
サービス時間、計画停止予定通知、サービス稼働率、ディザスタリカバリ、
重大障害時の代替手段、代替措置で提供するデータ形式、アップグレード方針
・信頼性
平均復旧時間、システム監視基準、障害通知プロセス、障害通知時間、
障害監視間隔、サービス提供状況の報告方法、ログ取得
・性能
オンライン応答時間、バッチ処理時間、同時接続利用者数
・サポート
提供時間帯(障害対応)、提供時間帯(一般問合)
・データ管理
バックアップの方法、バックアップデータの保存期間、データ消去の要件
・セキュリティ
公的認証取得の要件、第三者評価、情報取扱者の制限、情報取扱い環境、通信の暗号化レベル
- マルチクライアントか?自社専用サーバーか。
ネットワークも含めて、自社専用になっている方が説明しやすい
マルチクライアントであったときは、データ混在などのリスクを検討
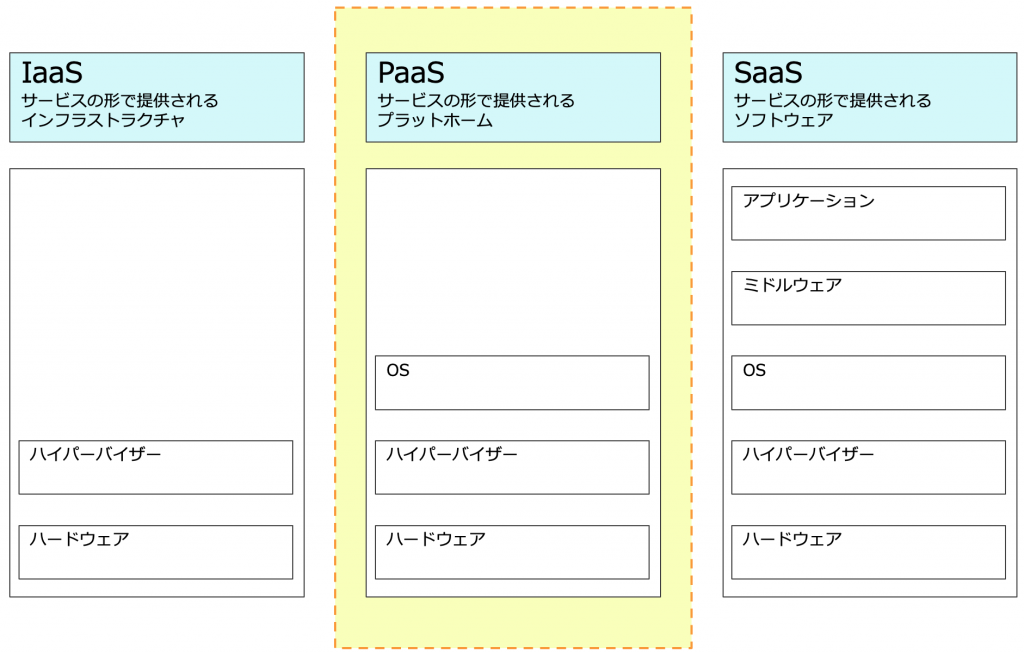
- 利用するシステムは、SaaS、PaaS、IaaSのどれか。
簡単に記すると
・SaaS
利用するコンピュータ化システムとその運用も含めて、マネジメントシステムと呼ばれる。正確にはマネジメントしてくれるシステム。
・PaaS:ハードとOS →この部分だけはマネジメント(維持運用)してくれる
・IaaS:ハードだけ →この部分だけはマネジメント(維持運用)してくれる
- システムカテゴリーはどのようにするか?
サーバー上で稼働するシステムでカテゴリー3は非常に稀だと思われる
・カテゴリ3:構成設定なし
・カテゴリ4:構成設定あり(ワークフロー設定など)
・カテゴリ5:コーティングあり(スクリプト、SQLなど含む)
- 物理的セキュリティ
・データセンターのおおよその所在地(激甚災害の場合の影響度把握)
・設備状況を確認したか
例)サーバー配置、冷却装置、ネットワーク設備
・入退出管理はどの様になっているか
例)入退出認証(人、時刻)、物品持込み持ち出しなどのシステム、記録
- ネットワーク構成|ER/ES要件 オープンシステムか、クローズドシステムか ※下記「ER/ES指針がこの話の元祖ですね」参照
■クローズドシステム
システム内の電磁的記録に責任を持つ者によって、システムへのアクセスを管理されているシステムER/ES指針
というわけで
システムまでのネットワーク経路を専用線、VPN、IPアドレス固定などを実施が必要
■オープンシステム
システム内の電磁的記録に責任を持つ者によって、システムへのアクセスを管理されていないシステム
電磁的記録が作成されてから受け取られるまでの間の真正性、機密性を確保するために必要な手段を適切に実施すること。追加手段には、電磁的記録の暗号化やデジタル署名の技術の採用などが含まれる。ER/ES指針
ということで
だれでもログイン画面にアクセスできるようなシステムはオープンシステムと定義される。
- システムのセキュリティは十分か?
・ID、パスワードの利用
・システムの利用は個人毎でのIDが必要
・2要素認証
・現在ではパスワードの定期的変更は推奨されない *1
- 端末はGMP業務専用か?インターネットにアクセスできる端末か?
- 個人情報管理
基本的に自社の個人情報保護方針に従って取り扱う。
- ログイン
パスワードの更新
定期的にパスワードを更新するようなルールを検討される企業が多いが、最近ではパスワードの定期的変更は推奨されてません。
これは利用者に定期的変更というルールを適用すると簡単なパスワードを利用するという傾向があり、結果的に煩雑なパスワード運用となるためです。そもそもパスワードだけではセキュリティは守れないという立場に立って、2段階認証などを活用するべきです。
■参考
総務省 安全なパスワード管理
- 監査証跡(audit trail)とは
監査証跡は、情報システムで実施された活動の記録です。人の作業による活動、システムが自動で実施する活動のどちらにも適用されます。システムの情報を利用される場合にその事実そのままに記録されているか(真正性)が一番のポイントだと思います。基本的には情報を、登録、変更、削除する場合は、いつ、誰が、何を、理由を残すことです。変更前の記録、変更後の記録があれば一番わかりやすいといえます。
以下の文章にも監査証跡に関する明記が有ります。
・医薬品等の承認又は許可等に係る申請等に関する電磁的記録・電子署名利用のための指針(ER/ES指針)
・コンピュータ化システム適正管理ガイドライン(案)パブリックコメント#22
・PIC/SのGMP ANNEX11の10章
最低限の監査証跡としては以下のような対応になります。
・だれが、いつ、システムを利用したかがわかる情報を保存する。
・ログイン時にユーザーID、パスワードを入力させる。当然、個人別のユーザーIDであることが必須。
・データを登録・変更・削除する際にその作業の承認者と実施者が、いつ実施したかが特定できる情報を保存する。
・上記に際して、理由も保存する。
・システムでデータが自動的に変更される場合は、その内容も保存する。
- 監査証跡が取れるか|変更管理
データインテグリティを考える上では、システムでは「監査証跡の確保」は基本中の基本です。これがなくては、GxP業務に対しては利用できないというのが一般的な評価となってきています。情報システムで実施された活動の記録。人の作業による活動、システムが自動で実施する活動のどちらにも適用されます。システムの情報を利用される場合にその事実そのままに記録されているか(真正性)が一番のポイント。基本的には情報を、登録、変更、削除する場合は、いつ、誰が、何を、理由を残すことです。変更前の記録、変更後の記録があれば一番わかりやすいといえます。
・自動的に取得できているか。
・開発、設定内容(運用会社、自社)・・・プログラム変更、インフラ変更など
・利用(自社)・・・・・・・・・・・・・ログイン、データ登録・変更、ダウンロード(参照は不要)
・運用(運用会社、自社)・・・・・・・・ユーザー登録、権限付与など
・変更削除等できないシステムになっているか
・「監査証跡の確認した」という記録が必要
・監査証跡レビューは、その承認ごとが推奨されている
・監査証跡は印刷可能のしておく
- 時刻設定|タイムスタンプ
・時刻設定は自動で時刻サーバーなどで同期されているか
・時刻設定は手動で変更で来ないようになっているか
・日時、時刻は他の運用、システムと同期が取れているか
・時刻設定は日常点検などされているか
- ワークフロー
・電子署名の要件を満たしているか→承認時にID、パスワード入力
・ワークフロー(ルート)はシステムに設定されているものを利用するようになっているか
・ルートを利用者が変更できないようになっているか
・運用中にルートに関わる内容に変更が出る場合の対応検討
ルート変更、組織変更、申請者・承認者の異動
- 文書管理
・1番最初からシステムに登録しているか?
紙に記録してシステムに登録しているか?→生データの定義
・生データ(最初に記載されたデータ)が紙の場合は紙の保存が必要
- 障害
・障害検知
・一時的に紙運用に戻すことを規定しておく。また、システム復旧時の対応も規定しおく。データの不正語など内容に手段が必要。オリジナル情報がシステムにしかなく、データが喪失している可能性も考えられる。また、紙管理となってしまった工程の内容をシステムに登録する手順も必要となる。
- 冗長性
・スタンバイ(ホット、コールド)を確認する - バックアップ、リストア
・薬事法及び関連法規、関連通知が定める期間保存できるか
・バックアップとアーカイブとは異なる
アーカイブ :一定期間を越えた、通常利用しないデータを別エリアに保管すること
「ちょっと避けとく」という感じ
バックアップ:データが破損などした場合に復元するためのデータ
アーカイブデータのバックアップも必要である
・バックアップ取得方法を確認する
この単位でリストアできる範囲が決まる。
例)テーブル単位、DB単位、システムまるごと、サーバーまるごと、複合
単位(時間、日、月)、保存期間、保存媒体、保管場所
・バックアップが変更されないように保管されているか
・データはエディターなどで簡単に見れるものか(例:CSVとか)
・データが固有システムである場合、そのシステムをデータ保有期間は維持できるか
・メタデータ、監査証跡も含めて保管されているか
・バックアップは真正コピーという扱いになる
・サプライヤーのバックアップだけで良いか検討する
システム以上の場合のみ利用されるもので、通常は利用者の都合ではリストアできない
例)このテーブルだけ戻したいとか
・システム導入時には、バックアップ/リストアテストを実施する
・定期点検時などに毎年テスト実施が必要
- 激甚災害対策
・システム再開の規定
・遠隔地バックアップ - 事業継続計画(BCP)
企業が自然災害、大火災、テロ攻撃などの緊急事態に遭遇した場合において、事業資産の損害を最小限にとどめつつ、中核となる事業の継続あるいは早期復旧を可能とするために、平常時に行うべき活動や緊急時における事業継続のための方法、手段などを取り決めておく計画のことです。 緊急事態は突然発生します。(wikipedia)参考サイト:経済産業省 - ディザスタリカバリ(DR)disaster recovery
事業継続マネジメントにおける概念のひとつで、災害などによる被害からの回復措置、あるいは被害を最小限に抑えるための予防措置のことである。 主にコンピュータシステムやネットワークなどIT関連で用いられることが多い。(wikipedia)
- システムをやめるとき(リタイヤメント)に
・データが取り出せるか?
・同システム中で削除できているか?確認書は提出いただけるか?
- サプライヤ監査の実施
- 日常点検の実施項目
・サーバ、システム稼働状況
・ネットワーク通信状態
・CPU使用率
・レスポンスタイム
・ディスク容量使用率
・OSログイン履歴
・DB確保容量使用率
・DB監査ログ
・バッチ処理結果
・サーバ、システムエラー監視 - 自己点検の実施項目(例)
・日常点検の記録実施状況
・定期点検の記録実施状況
・変更管理運用の確認
・逸脱、是正処置運用の確認
・管理者、利用者の教育訓練の確認
- 定期点検の実施項目(例)
・プログラムや構成の内容に不正な変更が加えられていないか
・定められた仕様通りのバージョンか
・バリデートされた状態が維持できているか
・変更管理(変更手続き、変更事項の検証、教育訓練、SOPの改訂等)、インシデント管理、日常点検
・セキュリティ管理(権限付与管理を含む)が適正に行われているか
・定期的に交換するべき部品等が適切に交換されているか
・クロック、計測機器等の校正が行われズレの補正が行われているか
・自己点検の目的はGMPの観点から自社のGMP管理方針(品質マニュアル、各種手順書)、コンピュータ化システム管理規定を順守して適切な製造管理及び品質管理を確保しているか確認し、必要な場合品質マネジメントレビューを通してGMP体制(人、手順、機器、システム)の改善を勧めるために行うである
- EXCELはGMP業務に利用できるのか?
基本的に「できない」というのが弊社の見解です。
・誰が記載したか明確するのは難しい
・記載方法を完全に規定することが難しい
・記載された日時を限定するのが難しい
・簡単にコピーができる
・権限設定が難しい
・監査証跡が取れない
・データ破損の可能性がある
などなど、前述したALCOAの原則に適合するのはできなくはないが、かなり難しいと考えています。
また、FDAからもEXCELに関するワーニングレターが多数報告 されています。以下、一部例です。
されています。以下、一部例です。
FDA WARNING LETTER
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/american-preclinical-services-562382-02122019
562382 — 2019/2/19
Your response noted the following corrective and preventive actions:holding GLP training for management;
・creating an Excel spreadsheet to document traceability;
・中略
・conducting staff training on labeling at the Annual GLP Refresher training session.
FDA WARNING LETTER
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/tismor-health-and-wellness-pty-limited-588104-12052019
Tismor Health and Wellness Pty Limited
588104 — 2019/12/5
Your firm failed to validate the Excel spreadsheet used to perform the assay calculation for your “(b)(4).” Your procedures lacked guidance on how to check and manually verify the calculation sheets. During the inspection, our investigator identified a calculation error within the spreadsheet. The incorrect formula for averaging the Internal Standard peak area was used.
FDA WARNING LETTER
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/tismor-health-and-wellness-pty-limited-588104-12052019
588104 — 2019/12/5
Your firm failed to validate the Excel spreadsheet used to perform the assay calculation for your “(b)(4).” Your procedures lacked guidance on how to check and manually verify the calculation sheets. During the inspection, our investigator identified a calculation error within the spreadsheet. The incorrect formula for averaging the Internal Standard peak area was used.
FDA WARNING LETTER
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/kyowa-hakko-bio-co-ltd-543924-08102018
Kyowa Hakko Bio Co., Ltd.
543924 — 2018/8/10
In your annual product reviews, you used unprotected Excel worksheets to perform calculations and statistical evaluations of production data, such as standard deviation and process capability. These electronic files were not secured to prevent unauthorized changes, and have no change history.
FDA WARNING LETTER
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/sichuan-friendly-pharmaceutical-co-ltd-546990-06222018
Sichuan Friendly Pharmaceutical Co., Ltd.
546990 — 2018/6/22
Failure to exercise sufficient controls over computerized systems to prevent unauthorized access or changes to data, and to have adequate controls to prevent omission of data. You used a non-validated Excel spreadsheet to calculate assay results for (b)(4) USP for product release and stability testing. Our investigator found that this spreadsheet lacked password protection and contained unlocked calculation formulas which were incorrect. During the inspection, your QC manager acknowledged that the formula in the spreadsheet used to calculate assay results was incorrect. Because of these incorrect formulas, multiple certificates of analysis (COA) contained inaccurate data.
FDA WARNING LETTER
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/sandoz-private-limited-445532-10222015
Sandoz Private Limited
445532 — 2015/10/22
On August 28, 2014, FDA investigators identified instances of non-contemporaneous documentation of batch production activities. Two uncontrolled Excel spreadsheets were used to record discrepancies and certain in-process drug quality data. This data was initially missing in the batch manufacturing record. Your firm later entered this data into batch records and backdated them.
すこし古い情報ですが、イーコンプライアンス様のサイトには「MS-Excelに関するワーニングレター」という情報がこちらに掲載されています。
https://ecompliance.co.jp/FDA/WarningLetters/excel.html
しかし!便利ですから、利用されているケースも多数あるようです。
ER/ES指針がこの話の元祖ですね。
医薬品等の承認又は許可等に係る申請等における電磁的記録及び電子署名の利用について
通称「ER/ES指針」は厚生労働省から通知された「医薬品等の承認又は許可等に係る申請等における電磁的記録及び電子署名の利用について」のことで、内容については、e―文書法 *2を前提として作成されています。内容としては短い文書ですが、内容は濃く、いろいろな解釈ができるため、実際に電子保存、電子署名を採用している企業は少ないのが現状です。しかし、最近では紙では保存しきれないビックデータや再解析可能な生データ、データインテグリティ(DI:Data Integrity)の高まりから、再注目されています。
「電磁的記録」という表現は、光メディアやクラウドが一般的になった今ではちょっと違和感のある言葉ですが、「電磁的記録」は概ね「電子的方式、磁気的方式その他の 知覚によって認識することができない方式で作られた記録 をいう。」と法律用語で定義されています。この定義は幅広い表現になっており、新技術が創出されても適用できるようになっています。法律用語はうまいこと定義されているなと感心します。
薬機法(当時は薬事法)にかかわる範囲での電磁的記録、電子署名について書かれたもので、製薬、化粧品、医療機器などを製造する企業を対象となります。アメリカ食品医薬品局 FDA(Food and Drug Administration)が出している21 CFR Part 11 *1と同様の要件がまとめられており、最近ではGDP(Good Distribution Practice)の施行もあって、製薬卸などにも広がりを見せています。
要求事項を簡単にいうと以下のとおり。
■電磁的記録
・管理はCSVされたシステムを利用すること
・以下の3つを維持すること
①真正性
・システムセキュリティの規則、手順(バックアップ含む)が文書化され、適切に実施されていること
・監査証跡 *3(作成、変更情報を含む)が自動的に記録され、予め定められた手順で確認できる
・情報を変更する場合は、変更前の情報も保存されるとともに、変更者が明確に識別できる
②見読性
・人が読める形式で出力ができること
③保存性
・保存期間内において、真正性及び見読性が確保された状態で保存できる
・保存性を確保するための手順が文書化され、適切に実施されていること
・他の電磁的記録媒体移行する場合にも真正性、見読性及び保存性が確保されていること
・オープン・システム *4の利用の場合は、電磁的記録が作成されてから受け取られるまでの間の真正性、機密性を確保するために追加手段を講じること
(電磁的記録の暗号化やデジタル署名の技術と同様技術の採用)
■電子署名
・電子署名及び認証業務に関する法律に基づき、管理・運用手順が文書化されていること
・各個人を特定できる唯一のものとし、他の誰にも再使用、再割当しないこと
・署名として署名者の氏名、署名が行われた日時、署名の意味(作成、確認、承認等)を含むこと
*1 21 CFR Part 11 FDAが電子記録、電子署名および電子記録を規制対象企業から受け入れることを可能とする法律
*2 e―文書法 行政手続等における情報通信の技術の利用に関する法律(平成14年法律第151号)及び民間事業者等が行う書面の保存等における情報通信の技術の利用に関する法律
*3 監査証跡 正確なタイム・スタンプ(コンピュータが自動的に刻印する日時)が付けられた一連の操作記録
*4 オープン・システム システム内の電磁的記録に責任を持つ者によって、システムへのアクセスが管理されていないシステム
*5 デジタル署名 署名者認証の暗号化技術等に基づく電子署名
そもそも、CSVも必要ですね
作業の工程、内容と作成ドキュメントは以下の通り
| 作業工程 | 作業内容 | ドキュメント内容 |
| 作業計画 | WBS作成、作業調整 | |
| 提案 | CSV適用を前提に御社のコンピュータ化システム管理規定などを理解して、開発計画書や要求仕様書(URS)に対しての提案 | |
| 開発計画 | 開発計画書の作成 | 目的 システムの概要 体制(組織、開発責任者、検証責任者) プロジェクトスケジュール |
| CSV計画 | バリデーション計画書 | 目的 システムの概要 バリデーション方針 検証、変更・逸脱の管理手順 バリデーションのスコープ バリデーション項目 適用される法規制及び適用する規定等 体制(組織、開発責任者、検証責任者) CSVスケジュール |
| 要求仕様(URS) | 要求仕様書(URS)の作成 | 適用される法規制及び適用する規定等 セキュリティ要件 システム基盤 システム機能 性能要件 運用要件 障害対策機能 |
| システムアセスメント | お客様のシステムアセスメントがスムーズに進むように、必要な資料・情報を迅速にご提供します。 | ソフトウェアカテゴリ分類 製品品質に対するリスクアセスメント 供給者アセスメント |
| 機能仕様 | 具体的なコンピュータ化システムの機能と性能を記載した機能仕様書を作成 | 機能仕様書(FS)基本設計書 |
| 設計仕様 | コンピュータ化システムの詳細機能を記載した設計仕様書を作成 | 設計仕様書(DS)詳細設計書 システム基盤設計仕様・・・クラウド構成、ネットワーク、サーバー構成 ソフトウェア設計仕様・・・画面設計、データベース・ファイル設計、機能・モジュール設計、インターフェース設計 |
| 設計時適格性評価(DQ) | トレーサビリティマトリックス(TMX)の作成 | 設計時適格性評価(DQ)計画/記録書 |
| プログラムの作成及びプログラムテスト | システムテスト計画書を作成、それに基づいてシステムテストを実施し、その結果を記録 | |
| システムテスト | システムテストの計画書/報告書 | |
| 受入試験 | 工場受入試験 弊社環境における最終試験を実施・現地受入れ試験 御社環境における最終試験を実施 (GAMP5に定義があります) | 工場受入試験(FAT)の計画書/報告書 現地受入試験(SAT)の計画書/報告書 |
| 据付時適格性評価(IQ) | 据付時適格性評価(IQ)計画/記録書 | |
| 運転時適格性評価(OQ) | 運転時適格性評価(OQ)計画/記録書 | |
| 性能適格性評価(PQ) | 性能適格性評価(PQ)計画/記録書 |
各国のデータインテグリティ関連ガイド(Data Integrity)
最近、もっとも話題になることが多いデータインテグリティ(Data Integrity)ですが、日本の企業でもFDAやMHRAなどの海外当局から査察で指摘される事例が出てきており、ワーニングレター(Warning Letter)まで、発出されることが散見されるようになってきました。かなり重点的な監査ポイントになっていることは間違いないと思います。
各国のガイドラインが発出され、そろそろ勢揃いした感じがあります。ただ、そのタイミングや内容はハーモナイズされているような、いないような。。。しかし、その内容を検討しなければならないでしょう。
そこで、ご存知だとは思いますが、できるかぎり情報だけを集めてみました。
お役に立てば幸いです。
■FDA(アメリカ食品医薬局)Computer Software Assurance for Production and Quality System Software 2022/9/13
CSAガイダンスが公開されました。
■FDA(アメリカ食品医薬品局)Data Modernization Action Plan 2021/3
進化する新しい科学に対するデータに基づいたが必要であるという見解を記載されています
■PIC/S ガイダンス 2021/6
GOOD PRACTICES FOR DATA MANAGEMENT AND INTEGRITY IN REGULATED GMP/GDP ENVIRONMENTS
■ISPE(国際製薬技術協会)GAMP RDIガイド 2020/11
ISPE GAMP RDI Good Practice Guide: Data Integrity by Design
■WHO(世界保健機関)ガイダンス(正式版)2020/6
DRAFT WORKING DOCUMENT FOR COMMENTS
Guideline on data integrity
■MHRA(英国規制当局)GxPガイダンス 2018/3
MHRA GxP Data Integrity Definitions and Guidance for Industry Draft version for consultation July 2016
英国医薬品庁が発出しているGxPにおけるデータインテグリティの定義と業界へのガイダンスです。対象はGLP、GCP、GMP、GDP、GVPなどGxP全般
■WHO(世界保健機関)ガイダンス(正式版)2016/5
Guidance on Good Data and Record Management Practices (GDRP)
出典
*1 総務省「国民のための情報セキュリティサイト:安全なパスワード管理」
*2 コンピュータ化システム適正管理 ガイドライン|CSV
■厚生労働省 医薬品・医薬部外品製造販売業者等におけるコンピュータ化システム適正管理ガイドラインについて
■厚生労働省 医薬品・医薬部外品製造販売業者等におけるコンピュータ化システム適正管理ガイドラインについて|PDF版
*3 コンピュータ化システム適正管理 ガイドラインに関する質疑応答集(Q&A)
*4 医薬品等の承認又は許可等に係る申請等における電磁的記録及び電子署名の利用について(ER/ES指針)
*5 PIC/S GMPガイドライン anex11 コンピューター化システム
*6 FDA 21CFR Part11(連邦法第21章第11条)
*7 FDA DIガイダンス(ドラフト)2016年4月15日Guidance for Indsutry Data Integrity and Compliance With CGMP
*8 MHRA GMP DIガイダンス(正式版)2015年3月MHRA GMP Data Integrity Definitions and Guidance for Industry March 2015
*9 MHRA GxP DIガイダンス(パブリックコメント用)2016年7月MHRA GxP Data Integrity Definitions and Guidance for Industry Draft version for consultation July 2016
*10 WHO DIガイダンス(正式版)2016年5月31Guidance on Good Data and Record Management Practices (GDRP)
*11 PIC/S GMP/GDP DIガイダンス(ドラフト)2016年8月10日GOOD PRACTICES FOR DATA MANAGEMENT AND INTEGRITY IN REGULATED GMP/GDP ENVIRONMENTS
*. 電子化情報の規制要件・発出物ハンドブック 日本製薬工業協会 医薬品評価委員会 電子化情報部会 タスクフォース


